Los electrones tienen una masa pequeña respecto al protón, y su movimiento genera corriente eléctrica en la mayoría de los metales. Estas partículas desempeñan un papel primordial en la química ya que definen las atracciones con otros átomos.
En un átomo eléctricamente neutro (sin carga eléctrica neta) el número de protones ha de ser igual al de electrones. De este modo, el número atómico también indica el número de electrones y define la configuración electrónica de los átomos.
En 1913 Henry Moseley demostró la regularidad existente entre los valores de las longitudes de onda de los rayos X emitidos por diferentes metales tras ser bombardeados con electrones, y los números atómicos de estos elementos metálicos. Este hecho permitió clasificar a los elementos en la tabla periódica en orden creciente de número atómico. En la tabla periódica los elementos se ordenan de acuerdo a sus números atómicos en orden creciente.
del hidrogeno y no tiene carga.
Fue el primer modelo atómico con bases científicas, fue formulado en 1808 por John Dalton. Este primer modelo atómico postulaba:
La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir.
Los átomos de un mismo elemento son iguales entre sí, tienen su propio peso y cualidades propias. Los átomos de los diferentes elementos tienen pesos diferentes.
Los átomos permanecen sin división, aún cuando se combinen en las reacciones químicas.
Los átomos, al combinarse para formar compuestos guardan relaciones simples.
Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.
Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos.
Sin embargo desapareció ante el modelo de Thomson ya que no explica los rayos catódicos ni la radioactiviadad.

Luego del descubrimiento del electrón en 1897 por Joseph John Thomson, se determinó que la materia se componía de dos partes, una negativa y una positiva. La parte negativa estaba constituida por electrones, los cuales se encontraban según este modelo inmersos en una masa de carga positiva a manera de pasas en un pastel (de la analogía del inglés plum-pudding model).
Modelo de Rutherford

Este modelo fue desarrollado por el físico Ernest Rutherford a partir de los resultados obtenidos en lo que hoy se conoce como el experimento de Rutherford en 1911. Representa un avance sobre el modelo de Thomson, ya que mantiene que el átomo se compone de una parte positiva y una negativa, sin embargo, a diferencia del anterior, postula que la parte positiva se concentra en un núcleo, el cual también contiene virtualmente toda la masa del átomo, mientras que los electrones se ubican en una corteza orbitando al núcleo en órbitas circulares o elípticas con un espacio vacío entre ellos. A pesar de ser un modelo obsoleto, es la percepción más común del átomo del público no científico. Rutherford predijo la existencia del neutrón en el año 1920, por esa razón en el modelo anterior (Thomson), no se habla de éste.
Modelo de Bohr
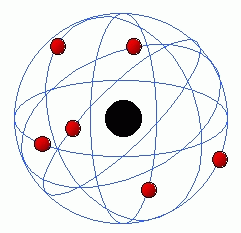
Este modelo es estrictamente un modelo del átomo de hidrógeno tomando como punto de partida el modelo de Rutherford, Niels Bohr trata de incorporar los fenómenos de absorción y emisión de los gases, así como la nueva teoría de la cuantización de la energía desarrollada por Max Planck y el fenómeno del efecto fotoeléctrico observado por Albert Einstein.
De acuerdo a esto, el átomo propuesto por Bohr consiste en un núcleo de hidrógeno alrededor del cual gira en órbitas circulares un electrón, ocupando la órbita permitida de menor energía, es decir, la más cercana al núcleo. El número de órbitas permitidas para el electrón se encuentra restringido por su nivel energético, y el electrón puede pasar a una órbita de mayor energía solamente absorbiendo una cantidad de energía específica (cuanto). El proceso inverso también es posible, que un electrón pase de una órbita de mayor energía a una de menor, liberando una cantidad específica de energía.
Luego de que Louis-Victor de Broglie propuso la naturaleza ondulatoria de la materia en 1924, la cual fue generalizada por Erwin Schrödinger en 1926, se actualizó nuevamente el modelo del átomo.
Modelo de Schrödinger: Modelo Actual

En el modelo de Schrödinger se abandona la concepción de los electrones como esferas diminutas con carga que giran en torno al núcleo, que es una extrapolación de la experiencia a nivel macroscópico hacia las diminutas dimensiones del átomo. En vez de esto, Schrödinger describe a los electrones por medio de una función de onda, el cuadrado de la cual representa la probabilidad de presencia en una región delimitada del espacio. Esta zona de probabilidad se conoce como orbital. La gráfica siguiente muestra los orbitales para los primeros niveles de energía disponibles en el átomo de hidrógeno y oxígeno.
Comentario------> En mi punto de vista las primeras teorias fueron con base fisiológica es decir no podian comprobar lo que decian, pero fueron saliendo nuevas teorias ya con base cientifica y estas se fueron modificando hasta llegar a la actual.
Aunque algunos elementos como el oro, plata, estaño, cobre, plomo y mercurio ya eran conocidos desde la antigüedad, el primer descubrimiento científico de un elemento ocurrió en 1669 cuando el alquimista Henning Brand descubrió el fósforo.
Un requisito previo necesario a la construcción de la tabla periódica era el descubrimiento de un número suficiente de elementos individuales, que hiciera posible encontrar alguna pauta en comportamiento químico y sus propiedades. Durante las siguientes 2 centurias, se fue adquiriendo un gran conocimiento sobre estas propiedades así como descubriendo muchos nuevos elementos.
El concepto actual de elemento químico según la idea expresada por Robert Boyle en su famosa obra The Sceptical Chymist, ciertos cuerpos primitivos y simples que no están formados por otros cuerpos, ni unos de otros, y que son los ingredientes de que se componen inmediatamente y en que se resuelven en último término todos los cuerpos perfectamente mixtos, desarrollado posteriormente por Lavoisier en su obra Tratado elemental de Química, condujo a diferenciar en primer lugar qué sustancias de las conocidas hasta ese momento eran elementos químicos, cuáles eran sus propiedades y cómo aislarlos.
El descubrimiento de un gran número de nuevos elementos, así como el estudio de sus propiedades pusieron de manifiesto algunas semejanzas entre ellos, lo que aumentó el interés de los químicos por buscar algún tipo de clasificación.
Triadas de Döbereiner
A estos grupos de tres elementos se les denominó triadas y hacia 1850 ya se habían encontrado unas 20, lo que indicaba una cierta regularidad entre los elementos químicos.
Döbereiner intentó relacionar las propiedades químicas de estos elementos (y de sus compuestos) con los pesos atómicos, observando una gran analogía entre ellos, y una variación gradual del primero al último. En su clasificación de las triadas (agrupación de tres elementos) Döbereiner explicaba que el peso atómico promedio de los pesos de los elementos extremos, es parecido al peso atómico del elemento de en medio. Por ejemplo, para la triada Cloro, Bromo, Iodo los pesos atómicos son respectivamente 35.5, 80 y 127; si sumamos 35.5 + 127 y dividimos entre dos, obtenemos 81.25, que es aproximadamente 80 y si le damos un vistazo a nuestra tabla periódica el elemento con el peso atomico aproximado a 80 es el bromo lo cual hace que concuerde un aparente ordenamiento de triadas.
Esta ley mostraba una cierta ordenación de los elementos en familias (grupos), con propiedades muy parecidas entre sí y en Periodos, formados por ocho elementos cuyas propiedades iban variando progresivamente.
El nombre de octavas se basa en la intención de Newlands de relacionar estas propiedades con la que existe en la escala de las notas musicales, por lo que dio a su descubrimiento el nombre de ley de las octavas.
Como a partir del calcio dejaba de cumplirse esta regla, esta ordenación no fue apreciada por la comunidad científica que lo menospreció y ridiculizó, hasta que 23 años más tarde fue reconocido por la Royal Society, que concedió a Newlands su más alta condecoración, la medalla Davy.
Grupos
A las columnas verticales de la Tabla Periódica se les conoce como grupos. Todos los elementos que pertenecen a un grupo tienen la misma valencia, y por ello, tienen características o propiedades similares entre si. Por ejemplo los elementos en el grupo IA tienen valencia de 1 (un electrón en su último orbital) y todos tienden a perder ese electrón al enlazarse como iones positivos de +1. Los elementos en el último grupo de la derecha son los Gases Nobles, los cuales tienen su último orbital lleno (regla del octeto) y por ello son todos extremadamente no-reactivos.
Los grupos de la Tabla Periódica, numerados de izquierda a derecha son:
Grupo 1 (IA): los metales alcalinos
Grupo 2 (IIA): los metales alcalinotérreos
Grupo 3 al Grupo 12: los metales de transición y metales nobles.
Grupo 13 (IIIA): el grupo del boro
Grupo 14 (IVA): el grupo del carbono
Grupo 15 (VA): el grupo del nitrógeno
Grupo 16 (VIA): los calcógenos o anfígenos
Grupo 17 (VIIA): los halógenos
Grupo 18 (Grupo 0): los gases nobles
Las filas horizontales de la Tabla Periódica son llamadas Períodos. Contrario a como ocurre en el caso de los grupos de la tabla periódica, los elementos que componen una misma fila tienen propiedades diferentes pero masas similares: todos los elementos de un período tienen el mismo número de orbitales. Siguiendo esa norma, cada elemento se coloca de acuerdo a su configuración electrónica. El primer período solo tiene dos miembros, hidrógeno y helio y ambos tienen solo el orbital 1s.
La tabla periódica tienen siete períodos:
Período 1
Período 2
Período 3
Período 4
Período 5
Período 6
Período 7
Sustancias químicas típicas que se pueden encontrar en el hogar son agua, sal (cloruro de sodio) y azúcar (sucrosa). En general, las sustancias existen como sólidos, líquidos, o gases, y pueden moverse entre estos estados de la materia mediante cambios en la temperatura o presión.
El concepto de sustancia química se estableció a finales del siglo XIIX con los trabajos del químico Joseph Proust sobre la composición de algunos compuestos químicos puros tales como el carbonato cúprico.[3] Proust dedujo que "todas las muestras de un compuesto tienen la misma composición; esto es, todas las muestras tienen las mismas proporciones, por masa, de los elementos presentes en el compuesto". Esto se conoce como la ley de las proporciones definidas, y es una de las bases de la química moderna.
Mezcla: Son materiales formados por dos o más sustancias en proporciones variables que conservan sus propiedades; las sustancias intervienen en cantidades variables; sus componentes pueden separarse por medios físicos (destilación, evaporación, cristalización, etc), generalmente no hay absorción o desprendimiento de energía al hacerlo (interacción química); las sustancias no estan químicamente combinadas, es decir, no se forman nuevas sustancias. Las disoluciones son aquellas en las que sus componentes se encuentran distribuidos uniformemente. Un tipo de mezcla puede ser la arena, el cemento, etc.
Las mezclas se clasifican en homogeneas y heterogenas, según esten constituidas por una fase o mas. Una fase es la porción de materia que tiene las mismas características y que es físicamente diferente de la otra porción de materia con la cual está en contacto.
Mezclas Homogéneas: (llamadas también soluciones), tienen apariencia uniforme y solo se ven como una sola fase. Presentan iguales propiedades en todos sus puntos. Se separan por cristalización, extracción, destilación y cromatografía. Estas mezclas se conocen más genéricamente como soluciones. Una solución está constituida por un “solvente”, que es el componente que se halla en mayor cantidad o proporción y uno o más “solutos”, que son las sustancias que se hallan dispersas homogéneamente en el solvente. El solvente universal es el agua, puede estar a una proporcion de 40/60 y el agua continua siendo el solvente en esa mezcla. Las partículas del soluto son tan pequeñas (moléculas, átomos o iones) que no se pueden ver ni siquiera con un ultramicroscopio. El tamaño de estas partículas es aproximadamente la cienmillonésima parte de un centímetro. Por esto no se sedimentan y, además, atraviesan un papel filtro.
Mezclas Heterogéneas: Presentan un aspecto no uniforme. Se separan por filtración, decantación y por separación magnética. Están formadas por dos o más sustancias puras que se combinan, conservando cada una sus propiedades particulares, de tal manera que podemos distinguir las sustancias que la componen. En las Mezclas heterogéneas podemos distinguir cuatro tipos de mezclas:
Coloides: son aquellas formadas por dos fases sin la posibilidad de mezclarse los componentes (Fase Sol y Gel)
Sol: Estado diluido de la mezcla, pero no llega a ser liquido, tal es el caso de la mayonesa, las cremas, espumas, etc.
Gel: Estado con mayor cohesión que la fase Sol, pero esta mezcla no alcanza a ser un estado solido como por ejemplo la jalea.
Suspensiones: Mezclas heterogéneas formadas por un sólido que se dispersan en un medio líquido.
En general, esta razón fija es debida a una propiedad intrínseca. Un compuesto está formado por moléculas o iones con enlaces estables y no obedece a una selección humana arbitraria. Por este motivo el bronce o el chocolate se denominan mezclas o aleaciones pero no compuestos.
Los elementos de un compuesto no se pueden dividir o separar por procesos físicos (decantación, filtración, destilación, etcétera), sino sólo mediante procesos químicos.
Los compuestos se dividen en tres grandes ramas:
Binarios: Son aquellos que tienen 2 elementos; destacan el Ácido, Óxido anhídrido, Sal, Peróxido, Hidruro.
Terciarios: Son aquellos que tienen 3 elementos; destacan Orto, Meta, Piro.
Cuaternarios: Son aquellos que tienen 4 elementos; en esta rama están comprendidos los radicales.
Los elementos principales, son el carbono (C), el oxígeno (O), el hidrógeno (H), y el nitrógeno (N), todos ellos capaces de formar enlaces covalentes muy estables al tener facilidad para compartir electrones de sus capas externas; además se trata de enlaces covalentes polares. La polaridad de los compuestos los hace solubles en agua o capaces de formar emulsiones o dispersiones coloidales y es de gran importancia para comprender la estructura de las membranas biológicas y sus propiedades. Dichos elementos constituyen aproximadamente el 95% de la materia viva.
En el caso del carbono, el átomo puede formar cuatro enlaces covalentes, no sólo con otros elementos, sino también con otros átomos de carbono para formar cadenas y enlaces. El carbono es el elemento esencial de todos los compuestos orgánicos.
El segundo grupo de elementos biogénicos esta formado por el fósforo (P), calcio (Ca), el magnesio (Mg), el sodio (Na), el potasio (K), el azufre (S) y el cloro (Cl) que se hallan en menores proporciones que los anteriores pero no por ello son menos importantes. Y lo mismo ocurre con los oligoelementos, indispensables para la vida por el papel biológico que desempeñan. Entre los principales componentes de este tercer grupo se hallan el hierro (Fe), que forma parte de la hemoglobina de la sangre de ls vertebrados, yodo (I), integrante de la hormona tiroxina producida por la tiroides, el manganeso (Mn), el cobre (Cu), el cobalto (Co) y el cinc (Zn).
Los elementos biogenésicos también son conocidos como bioelementos, y a su vez forman las biomoléculas que son las que forman a los seres vivos; éstas pueden conformrse de un mismo elemento repetido, en combinaciones y algunas, como las proteínas llegan a constituirse de miles de átomos de elementos diferentes.
Entre otros elementos biogenésicos están también, el fluor (F), Molibdeno (M), cobalto (Co), aluminio (Al), boro (B), vanadio (V), silicio (Si), estaño (Sn), níquel (Ni), cromo (Cr).
La contaminación es la introducción en un medio cualquiera de un contaminante, es decir, la introducción de cualquier sustancia o forma de energía con potencial para provocar daños, irreversibles o no, en el medio inicial.
Se denomina contaminación ambiental a la presencia en el ambiente de cualquier agente (físico, químico o biológico) o bien de una combinación de varios agentes en lugares, formas y concentraciones tales que sean o puedan ser nocivos para la salud, la seguridad o para el bienestar de la población, o bien, que puedan ser perjudiciales para la vida vegetal o animal, o impidan el uso normal de las propiedades y lugares de recreación y goce de los mismos. La contaminación ambiental es también la incorporación a los cuerpos receptores de sustancias sólidas, liquidas o gaseosas, o mezclas de ellas, siempre que alteren desfavorablemente las condiciones naturales del mismo, o que puedan afectar la salud, la higiene o el bienestar del público.
Contaminación por vertido de petróleo.
Se refiere a la contaminación que se produce en un lugar determinado por la presencia de focos productores de altos decibeles sonoros, que perturban, desequilibran y destruyen la calma relativa que en ese sitio existía antes de que dichos focos se activaran.
Contaminación química
Se refiere a cualquiera de las comentadas en los apartados anteriores, en las que un determinado compuesto químico se introduce en el medio.
Contaminación radiactiva
Es aquella derivada de la dispersión de materiales radiactivos, como el uranio enriquecido, usados en instalaciones médicas o de investigación, reactores nucleares de centrales energéticas, munición blindada con metal aleado con uranio, submarinos, satélites artificiales, etc., y que se produce por un accidente (como el accidente de Chernóbil), por el uso o por la disposición final deliberada de los residuos radiactivos.
Contaminación térmica
Se refiere a la emisión de fluidos a elevada temperatura; se puede producir en cursos de agua. El incremento de la temperatura del medio disminuye la solubilidad del oxígeno en el agua.
Contaminación acústica
Es la contaminación debida al ruido provocado por las actividades industriales, sociales y del transporte, que puede provocar malestar, irritabilidad, insomnio, sordera parcial, etc.
Contaminación electromagnética
Es la producida por las radiaciones del espectro electromagnético que afectan a los equipos electrónicos y a los seres vivos.
Contaminación lumínica
Se refiere al brillo o resplandor de luz en el cielo nocturno producido por la reflexión y la difusión de la luz artificial en los gases y en las partículas del aire por el uso de luminarias ó excesos de iluminación, así como la intrusión de luz o de determinadas longitudes de onda del espectro en lugares no deseados.
Contaminación visual
Se produce generalmente por instalaciones industriales, edificios e infraestructuras que deterioran la estética del medio.
Contaminación microbiológica
Se refiere a la producida por las descargas de aguas servidas en el suelo, cursos superficiales o subterráneos de agua. Son generadoras de enfermedades hídricas.
Desarrollo del examen
1) Dibuja y explica el modelo atómico de:
Rutherford.- 
El modelo atómico del fisico Rutherford (modelo o teoría sobre la estructura del átomo) fue propuesto por el físico Ernest Rutherford para explicar los resultados de su "experimento de la lámina de oro". Mantenía la idea de Joseph Thomson de que los átomos poseen electrones, pero sostenía que estos se encontrarían girando alrededor de un núcleo central. En ese núcleo se concentraría toda la carga positiva del átomo y casi toda la masa, y su tamaño debía ser muy pequeño en comparación al de todo el átomo.
Según Rutherford, las órbitas de los electrones no están muy bien definidas y forman una estructura compleja alrededor del núcleo, dándole un tamaño y forma algo indefinidas. No obstante, los resultados de su experimento, permitieron calcular que el radio del átomo era diez mil veces mayor que el núcleo mismo, lo que hace que haya un gran espacio vacío en el interior de los átomos.
Bohr.- 
En este modelo los electrones giran en órbitas circulares alrededor del núcleo, ocupando la órbita de menor energía posible, o la órbita más cercana al núcleo posible. El electromagnetismo clásico predecía que una partícula cargada moviéndose de forma circular emitiría energía por lo que los electrones deberían colapsar sobre el núcleo en breves instantes de tiempo. Para superar este problema Bohr supuso que los electrones solamente se podían mover en órbitas específicas, cada una de las cuales caracterizada por su nivel energético. Cada órbita puede entonces identificarse mediante un número entero n que toma valores desde 1 en adelante. Este número "n" recibe el nombre de Número Cuántico Principal.
1) Establece dos diferencias entre :
M. homogénea
M. heterogénea
forma
-Esta compuesto por un solo elemento.
-Tiene varios elementos en su composición.
estructura
-Tiene un color entero y todos sus elementos tienen as mismas propiedades.
-Tienen partes diferentes y distintas propiedades.
2) has la configuración electrónica y grafica de :
f = 9 => (He) 2s2 2px2 2py 2 2pz1
p = 15 => (Ne) 3s2 3px1 3py1 3pz1
3) escribe literalmente la configuración electrónica simplicada de:
Sm = 62 => (Xe) 6s2 4fx2 4fy2 4fz2
Os = 76 => (Xe) 6s2 4f14 5dx2 5dy2 5dz2
4) menciona el aporte al aporte mecánico quántico y el orden de los electrones.
De broglie: los electrones giran de forma circular y ondulatoria (dualidad de la materia)
Heisemberg: No es posible que calcular con exactitud la velocidad y la posición del electrón por ello debemos tener una idea aproximada (reempe) => Principio de incertidumbre.
Wolfgang pauli: Es suyo el principio de exclusión, según el cual es imposible que dos electrones -en un átomo- puedan tener la misma energía, el mismo lugar, e idénticos números cuánticos.
5) haz una breve descripción de la tabla periódica:
En que se baso: números atómicos en forma creciente.
Estructura principal: gupos y periodos.
Nombre de 2 familias de metales: alcalinos y alcalino térreos.
Nombre de dos familias de no metales: anfigenos y halogenos.
6) escribe dos alternativas con argumentos validos que ayuden a preservar el medio del daño que ocasionan los productos químicos a que hacen mención la prensa escrita los últimos días:
-> Utilizar los materiales necesarios y útiles para extraer los minerales, sin tener que perjudicar la flora y el agua de nuestros ríos, ya que esto afecta al medio.
-> No desechar los restos en los ríos porque el agua de estos va hacia las diversas plantas del medio y estas son afectadas, por lo tanto están dañando los pulmones de la tierra, además no deben usar mucho material tecnológico porque estos generan la contaminación ambiental.
- Elementos representativos: Son los elementos que en un mismo grupo no varían sustancialmente es decir sus propiedades son similares.
1.1) Anota los símbolos de los elementos que constituyen
- IA o alcalinos: H, Li, Na, K, Rb, Cs, Fr
- IIA o alcalino térreos: Be, Mg, Ca, Sr, Ba, Ra
- IIIA o anfígenos: no existe este grupo porque el número no corresponde con el nombre del grupo.
- IV o gases nobles: no existe este grupo porque el número no corresponde con el nombre del grupo porque el número no corresponde con el nombre del grupo.
2) Cual fue el aporte de:
- Rydberg: Descubrió que los elementos químicos son función periódica de sus números atómicos.
- Moseley: Comprobó con rayos x el enunciado de Rydberg.
3) Define:
- Energía de ionización: Es la fuerza de un átomo para desalojar el electrón del último nivel.
- Afinidad electrónica: Fuerza que tiene un átomo para atraer el electrón del último nivel.
4) Enumera los criterios tomados en cuenta para asignar el nombre de los elementos.
- Se tomo en cuenta el nombre del descubridor o científico.
- Se tomo en cuenta el nombre del país o ciudad donde fue descubierto.
5) ¿Estas de acuerdo con el ministro de energía y minas para formalizar la minería artesanal?
- No porque los desechos de la minería artesanal, realizada en las lomas, van directamente a las aguas de los ríos y perjudica el medio ambiente.
- Además, las aguas de los ríos son regadío de muchas plantas y esta agua están contaminadas por lo que perjudica también a la flora.
Correción de la 2º prueba
1) ¿Qué criterios debes considerar para determinar el tipo de enlace químico para formar una molécula de un compuesto?
- Saber la electronegatividad de c/u de los elementos.
- Saber el número de electrones en el último nivel.
2) Completa el cuadro
- tipos de enlace:
Criterio | Nombre | Nombre |
Electronegatividad | Polar | Apolar |
Compartición equitativa | normal | dativa |
Clases de Quimica
Nomenclatura Tradicional
Nombre Genérico → Nombre de la función.
Nombre Especifico → Nombre del Metal.
- Cuando tiene varios estados de oxidación, es:
- Terminación “ico”: Cuando lleva el mayor estado de oxidación, o también cuando tiene un solo estado de oxidación.
- Terminación “oso”: Cuando lleva el menor estado de oxidación.
Nomenclaturas de los compuestos quimicos
Nomenclatura Stock
- Se utiliza para los elementos que que posee 2 o mas estados de oxidación.
- Fe+2 + O-2 → FeO
- Oxido de Fierro (II)
Nomenclatura Iupac
- Utiliza el número de veces que se repite el ion metalicodel compuesto.
- Se utiliza cuando hay 2 o mas:
1: Mono
2: Di
3: Tri
4: Tetra
5: Penta
Oxidos
- Un oxido se forma con un elemento químico y un oxido.
- Metal + Oxido → Oxido Metalico
- No metal + Oxido → Oxido No metalico
- Estados de Oxidación de los Elementos Metálicos
1.- Litio (Li) → +1
2.- Sodio (Na) → +1
3.- Potasio (K) → +1
4.- Rubidio (Rb) → +1
5.- Cesio (Cs) → +1
6.- Francio (Fr) → +1
7.- Plata (Ag) → +1
8.- Mercurio (Hg) → +1, +2
9.- Cobre (Cu) → +1, +2
10.- Cinc (Zn) → +2
11.- Berilio (Be) → +2
12.- Magnesio (Mg) → +2
13.- Calcio (Ca) → +2
14.- Estroncio (Sr) → +2
15.- Bario (Ba) → +2
16.- Radio (Ra) → +2
17.- Aluminio (Al) → +3
18.- Oro (Au) → +1, +3
19.- Plomo (Pb) → +2, +4
20.- Platino (Pt) → +2, +4
21.- Estaño (Sñ) → +2, +4
22.- Iridio (Ir) → +2, +4
22.- Fierro (Fe) → +2, +3
23.- Cobalto (Co) → +2, +3
24.- Niquel (Ni) → +2, +3
Li+1 + O-2 → Li2O
- Oxido Litico o Oxido de Litio
- Monoxido de Dilitio
Fe+2 + O-2 → FeO
- Oxido de Fierro o Oxido Ferrico
- Oxido de Fierro (II)
- Dioxido de Fierro
Anhídridos o Oxidos Acidos o Oxidos No Metalicos
Estados de Oxidación de los Iones No metalicos
1.- Boro (B) → -3, +3
2.- Carbono (C) → -2, +2, +4
3.- Silicio (Si) → -2, +2, +4
4.- Nitrógeno (N) → -3, +3, +5
5.- Fosforo (P) → -3, +3, +5
6.- Arsénico (As) → -3, +3, +5
7.- Antimonio (Sb) → -3, +3, +5
8.- Asufre (S) → -2, +2, +4, +6
9.- Selenio (Se) → -2, +2, +4, +6
10.- Teluro (Te) → -2, +2, +4, +6
11.- Fluor (F) → -1
12.- Cloro (Cl) → -1, +1, +3, +5, +7
13.- Bromo (Br) → -1, +1, +3, +5, +7
14.- Yodo (I) → -1, +1, +3, +5, +7
- B+3 + O-2 → B2O3
- Anhídrido De Boro o Anhídrido bórico
- Tritóxido de Diboro
- C+2 + O-2 → CO
- Anhídrido Carbonoso
- Oxido de Carbono (II)
- Monóxido de Carbono
- N+3 + O-2 → N2O3
- Anhídrido Nitroso
- Oxido de Nitrógeno (III)
- Tritóxido de Dinitrogeno
Hidroxidos
- Se forma con ión Metálico mas un oxidrilo (OH)
Ejemplos:
1.- Fe+2 + (OH)-1 → Fe(OH)2
- Hidroxido Ferroso
- Hidroxido de Fierro (II)
- Dihidroxi de Fierro.
2.- Pb+2 + (OH)-1 → Pb(OH)2
- Hidroxido Plumboso
- Hidroxido de Plomo (II)
- Dihidroxi de Plomo.
3.- Cu+2 + (OH)-1 → Cu(OH)2
- Hidroxido Cuprico
- Hidroxido de Cobre (II)
- Dihidroxi de Cobre.
4.- Au+3 + (OH)-1 → Au(OH)3
- Hidroxido Aurico
- Hidroxido de Oro (III)
- Dihidroxi de Oro.
5.- Hg+2 + (OH)-1 → Hg(OH)2
- Hidroxido Mercurico
- Hidroxido de Mercurio (II)
- Dihidroxi de Mercurio
SALES:
Sales Neutras:
Sal Oxisal:
Nombre Genérico Nombre Específico
Nombre especifico del acido nombre especifico del hidróxido
OSO-->ITO
ICO-->ATO
3H2CO2 + 2Co (OH)3 -->Co2 (CO2 )3 + 6 H2O --> Carbonito Cobaltico.
Sal Haloidea:
Nombre Generico: Nombre Específico
Nombre genérico del acido nombre especifico del hidróxido
Hídrico-->URO
HI + Cu (OH) --> Cu I + H2O
Ejercicios:
SAL OXISAL:
H2CO2 + Be (OH)2 --> Be (CO2) + 2H2O --> Carbonito de Berilio.
H2SeO3 + Ca (OH)-->Ca (SeO3) + 2H2O --> Selenito de Calcio.
H2SO4 + Hg (OH)2 ---> Hg (SO4) + 2H2O --> Sulfato mercúrico.
SAL HALOIDEA:
H2S + Hg (OH)2 --> Hg (S) + 2H2O--> Sulfuro mercúrico.
H2Te + Ir (OH)2 --> Ir (Te) + 2H2O --> Teluro Iridoso.
H Cl + Rb (OH) --> Rb (Cl) +H2O --> Cloruro de Rubidio.
SALES ACIDAS:
-En la Sales Acidas Tienen que sobrar hidrógenos.
H2CO3 + Na (OH) --<> Bi carbonato de Sodio.
Nota: Se pone el prefijo “Bi” cuando se utiliza la mitad del hidrogeno (sales Acidas) cuando se reemplaza sin utilizar coeficientes.
Ejercicios:
Sal Oxisal Acida:
H2CO4 + Fr (OH) --> Fr H (CO4) + H2O --> Bi Peroxicarbonato de francio.
H2TeO5 + Li (OH) --> Li H (TeO5) + H2O --> Bi Peroxitelurato lítico.
H3PO4 + Rb (OH) --> Rb H2 (PO4) + H2O --> Fosfato acido de rubidio.
Sal Haloidea Acida:
4 H I + Ca (OH)2 ---> Ca H2 (I)4 + 2H2O ---> Yoduro acido de calcio.
2H2Te + Rb (OH) --> Rb H3 (Te)2 + 2H2O --> Teluro acido de rubidio.
2H2F2 + Pb (OH)2 --> Pb H2 (F2)2 + 2H2O --> Fluoruro acido plumboso.
SALES BASICAS:
-En este tipo de sales deben sobrar oxidrilos.
Ejercicios:
Sal Oxisal Básica:
H2CO4 + 3Fr (OH) --> Fr3 OH (CO4) + 2H2O --> Carbonato Básico de francio.
H3PO4 + 3Ba (OH)2 --> (Ba OH)3 (PO4) + 3H2O --> Fosfato tri básico de Bario.
H2SO5 + 2Hg (OH)2 --> (Hg OH)2 (SO5) + 2H2O --> Peroxisulfato di básico mercúrico.
Sal Haloidea Básica:
H2S + Al (OH) --> Al (OH) (S) + 2H2O -->Sulfuro básico de Aluminio.
H I + 2Au (OH) --> Au2 (OH) (I) + H2O --> Yoduro Básico Auroso.
H2Te + 2Pt (OH)-->(Pt OH)2 (Te) + 2H2O -->Teluro di básico platinoso.
SALES DOBLES:
E. Química Normal:
2H2SO4 + 2Na (OH)--> Na2 Fe (SO4)2 + 4H2O--> Sulfato Sódico Ferroso.
Fe (OH)2
IONICA:
2(SO4)2 + 2Na+1 --> Na2 Fe (SO4)2 --> Sulfato Sódico Ferroso.
Fe+2
Ejercicios:
Sal Oxisal Doble:
Iónica:
5(NO3) + Hg +2 --> Hg Au (NO3)5 --> Nitrato doble mercúrico áurico.
Au+3
4(CO2) + Pb+2 --> Pb Fe2 (CO2)4 --> Carbonito doble plumboso ferrico.
2Fe+3
E. QUIMICA:
5HClO4 + Cu (OH)2 --> Cu Al (ClO4)5 + 5H2O--> Híper clorato doble cúprico de aluminio.
Al (OH)3
4H2TeO3 + Hg (OH)2 --> Hg Au2 (TeO3)4 + 8H2O --> Telurito doble mercúrico áurico.
2Au (OH)3
Sal Haloidea Doble:
IONICA:
4(Te)-2 + Cu +2 --> Cu Al3 (Te)4--> Teluro doble mercúrico de aluminio.
2Al +3
5(Cl)-1 + Hg +2 ---> Hg Au (Cl)5 --> Cloruro doble mercúrico áurico.
Au+3
E. QUIMICA:
5H I + Cu (OH)2 ---> Cu Au (I)5 + 5H2O ---> Yoduro doble cúprico áurico.
Au (OH)3
4H2S + Hg (OH)2 --> Hg Al2 (S)4 + 8H2O --> Sulfuro doble mercúrico de aluminio
2Al (OH)3
Corrección de la prueba de química
1.-Escribe los nombres de los siguientes compuestos:
Pb(OH)4
- Hidroxido Plúmbico
- Hidroxido de plomo (IV)
- Tetrahidroxi de plomo
Ag(OH)
- Hidroxido de plata
- Monohidroxi de plata
Au(OH)
- Hidroxido airoso
- Hidroxido de oro(I)
- Monohidroxi de oro
Mg(OH)3
- No existe, ya que el estado de oxidación del Magnesio es +2
Ni(OH)3
- Hidroxido Niquélico
- Hidroxido de Niquel (III)
- Monohidroxi de Niquel
2.- Resuelve:
1.- Realiza Ecuación química
Corrección de la Segunda Prueba de Química
1.- Escribe el nombre de los siguientes ácidos:
a) Acido Carbónico
- Anh. Carbónico + Agua
CO2 + H2O H2CO3
b) Acido Cloroso
- Anh. Cloroso + Agua
Cl2O3 + H2O 2HClO2
c) Acido Nitroso
- Anh. Nitroso + Agua
N2O3 + H2O 2HNO2
d) Acido Hiperyódico
- Anh. Hiperyódico + Agua
I2O7 + H2O 2HIO4
e) Acido Sulfúrico
- Anh. Sulfúrico + Agua
SO3 + H2O H2SO4
Tercera Prueba de Química
1.- Escribe los nombres de los siguientes compuestos
a) HNO2
- Acido Nitroso
b) Co(OH)3
- Hidróxido cobaltico
- Hidróxido de cobalto (III)
- Trihidroxi de cobalto
c) HIO3
- Acido Yódico
d) Au(OH)3
- Hidróxido Aurico
- Hidróxido de Oro (III)
- Trihidroxi de Oro
e) H2CO3
- Acido de Carbónico
2.- Escribe la ecuación química:
a) Acido Selenoso
SeO2 + H2O → H2SeO3
b) Hidróxido Cúprico
CuO + H2O → Cu(OH)2
c) Acido Telúrico
TeO3 + H2O → H2TeO4
d) Acido Hipoyodoso
I2P + 2H2O → 2HI
e) Hidróxido Platinico
PtO2 + 2H2O → Pt(OH)4
Cuarta Prueba de Química
1.- Escribe la formula de los siguientes compuestos
a) Acido Yodoso
HNMO1+E.O/2 → HIO2
b) Acido Carbonico
H2CO2+4/2 → H2CO3
c) Acido Fosforico
H3PO3+5/2 → H3PO4
d) Acido Selenico
H2SeO4
e) Acido Nitroso
HNO2
2.- Escribe la ecuación química para obtener los siguientes compuestos químicos
a) Acido hiperclorico
Cl2O7 + H2O → HClO
b) Acido Antimonico
Sb2O + 3H2O → 2H3SbO3
c) Acido Silicico
SiO + H2O → H2SO3
d) Acido Borico
B2O3 + 3H2O → 2H3BO3
e) Acido Hiposulfuroso
SO + H2O → H2SO2
Corrección de la Quinta Prueba de Química
1.- Escribe la ecuación química de los siguientes compuestos:
a) Acido Ortofosforico
P2O5 + 3H2O → 2H3PO4
b) Acido Piroselenoso
2SeO3 + H2O → H2Se2O5
c) Acido Ditiocarbonico
CO2 + H2O → H2CO3 → H2COS2
d) Acido Metahiperyodico
I2O7 + H2O → 2HIO4
e) Acido Sulfoclorico
Cl2O5 + H2O → 2HClS3
f) Acido Piroantimonico
Sb2O5 + 2H2O → H4Sb2O7
f) Acido Ortotelurico
TeO3 + 2H2O → H4TeO5
g) Acido Titrionitrico
- No existe porque si realizamos la ecuación química habrían tres azufres, y por lo tanto yo no se llamaría “Titrionitrico”, sino “Sulfonitrico”, ya que el oxigeno ha sido reemplazado totalmente por el azufre.
Corrección de la Sexta Prueba de Química
1.- Escribe la Ecuación Química de los siguientes compuestos:
a) Acido Ditiocarbonico
CO2 + H2O → H2COS2
b) Acido Tetrahiperyodico
2I2O7 + H2O → H2I4O15
c) Acido Peroxisulfurico
SO3 + H2O2 → H2SO5
d) Acido Diborico
B2O3 + H2O → 2HBO2
e) Acido Peroxinitrico
N2O5 + H2O2 → H2N2O7
f) Acido Sulfoortocarbonoso
CO + 2H2O → H2CS3
g) Acido Pentahipoyodoso
- No existe porque el número de iodos es par, y nos piden hallar cinco Iodos, y no se puede.
h) Acido Peroxiantimonioso
- No existe porque la función de Peroxiacidos funciona solo con los compuestos que tiene terminación “ico”
2.- Escribe los nombres de los siguientes compuestos:
a) CH4
- Metano
- Hidruro de carbono o Carbonico
b) H2S
- Acido Sulfuhidrico
- Hidruro de Azufre o Sulfurico
c) NH3
- Amoniaco
- Hidruro de Nitrogeno o Nitrico
d) HBr
- Acido Bromhidrico
- Hidruro de Bromo o Bromico
e) PH3
- Fosfina
- Hidruro de fosforo o fosforico
f) HI
- Acido Iodhidrico
- Hidruro de Iodo o Iodico
g) BH3
- Borano
- Hidruro de Boro o Borico
h) H2Se
- Acido Selenhidrico
- Hidruro de Selenio o Selenico
Corrección de la Septima Prueba
1.- Escribe la formula de:
a) Hidruro Platinico
PtH4
b) Borano
BH3
c) Acido Selenhidrico
H2Se
d) Hidruro Cobaltoso
CoH2
e) Amoniaco
NH3
f) Hodruro Calcico
CaH2
g) Fosfina
PH3
h) Acido Clorhidrico
HCl
2.- Escribe el nombre de:
a) AsH3
- Arsina
- Hidruro de Arsenico o Arsenico
b) IrH2
- Hidruro Iridioso
- Hidruro Iriodioso
c) HBr
- Acido Bromhidrico
- Hidruro de Bromo o Bromico
d) CoH2
- Hidruro Cobaltoso
- Hidruro de Cobalto
e) CH4
- Metano
- Hidruro de carbono o Carbonico
f) AuH
- Hidruro Auroso
- Hidruro deOro (I)
g) SiH2
- Silano
- Hidruro de Silicico
Octava prueba
1) Nitrato de magnesio
2HNO3 + Mg (OH)2 → Mg NO3 + 2H2O
2) Selenuro de plata
H2Se + 2 Ag (OH) → Ag 2Se + 2H2O
3) Borato ácido de cobre
H3BO3 + Cu (OH)2 → Cu HBO3 + 2H2O
4) Yoduro ácido potásico
2HI + K(OH) → KHI2 + 2H2O
5) Hiperbromato aurico
3H Br O4 + Au(OH)3 → Au (Br O4)3 + 3H2O
6) Fluoruro mercuroso
2H2F2 + 2Hg (OH) → Hg2 F2 + 2H2O
7) Carbonato diácido
2H2CO3 + Pt(OH)2 → Pt H2 (CO3)2 + 2H2O
8) Sulfuro ácido de litio
H2S + Li (OH) → Li H S + H2O
9) Ortofosfato de berilio
2H3PO4 + 3Be (OH)2 → Be3 (PO4)2 + 6H2O
10) Cloruro férrico
3HCl +Fe(OH)3 → Fe Cl 3 + 3H2O
Novena Prueba
1.- Escribe la ecuación química de los siguientes compuestos:
a) Nitrato de Magnesio
2HNO3 + Mg(OH) → Mg(NO3)2 + 2H2O
b) Sulfuro de Litio
H2S + 2Li(OH) → Li2(S) + 2 H2O
c) Arsenato Acido de Mercurio
H3AsO4 + Hg(OH) → HgH(AsO4) + 2 H2O
d) Cloruro Acido Potasico
2HCl + K(OH) → KH(Cl)2 + H2O
e) Hiperyodato Aluminico
3HIO4 + Al(OH)3 → Al(IO4)3 + 3 H2O
f) Fluoruro Cuprico
3H2F2 + 2Cu(OH)2 → Co(F2)3 + 6 H2O
g) Slicato Acido Platinoso
H2SiO3 + Pt(OH)2 → No existe porque desdobndo el hidrogeno nunca me sobrara 1.
h) Selenuro Acido Sodico
H2Se + Na(OH) → NaH(Se) +
DÉCIMO EXAMÉN:
1.- Sulfato de Litio y Potasio
H2SO4 + Li (OH) - LiK (SO4) + 2H2OK(OH)
2.- Cloruro de Calcio y Magnesio
4HCl + Ca (OH)2 - Ca Mg (Cl)4 + 4H2OMg (OH)2
3.- Carbonato Cuproso y Magnesio
2H2CO3 + 2Cu (OH) - Cu2 Mg (CO3)2 + 4H2OMg (OH) 2
4.- Fluoruro de Sodio y Mercuroso
H2F2 + Na (OH) - Na Hg (F2) + 2H2OHg (OH)
5.- Nitrato de Bario y Cálcico
4HNO3 + Ba (OH) 2 - Ba Ca (NO3)4 + 4H2OCa (OH)2
6.- Selenuro de Sodio y Plata
H2Se + Na (OH) - Na Ag (Se) + 2H2OAg (OH)7.- Hiperclorato Potásico y Argéntico2HClO4 + K (OH) è K Ag (Clo4)2
La Minería en el Perú
EVOLUCION
La historia del Perú esta ligada a la historia de la minería, la presencia hispana no hizo sino ratificar dicha apreciación, experiencia que costó al sistema social andino, su desarticulación política, social y económica, con la subsiguiente explotación irracional de los recursos mineros existentes en el área andina.
Desde inicios de la República, la minería ha sido uno de los sectores más dinámicos de la economía peruana. El oro y la plata y, posteriormente, los metales básicos han sido los pilares de la minería peruana. En la actualidad, Perú es el octavo productor de oro en el mundo, el segundo de plata, el séptimo de cobre, y el cuarto de zinc y de plomo. La producción minera se destina principalmente a mercados externos, por lo que la minería se convierte en un importante generador de divisas. Asimismo, la explotación minera se realiza muchas veces en zonas alejadas en donde no se realizan otras actividades productivas, convirtiéndose así en un importante impulso económico, al proveer de infraestructura física y de servicios sociales básicos.
En la actualidad esta actividad económica, de suma importancia para el desarrollo nacional, vuelve a cobrar vigencia plena, donde los mecanismos de explotación minera se orientan con un criterio integral que marche en armonía con el medio ambiente, evitando su contaminación y destrucción sistemática, campo de acción al cual no es ajena la actividad arqueológica, teniendo en cuenta que en el marco de la legislación vigente los recursos culturales están amparados por normas y disposiciones que regulan el tratamiento de los mismos, con la finalidad de prevenir su pérdida definitiva, que por el hecho de ser bienes no renovables, su afectación tiene carácter de irreversible, de allí la necesidad de impulsar trabajos de liberación y rescate arqueológico con el objeto de conocer el valor histórico del área de estudio.
Recursos mineros explotados y no explotados
http://www.cideiber.com/infopaises/Peru/Peru-04-05.html
En el Perú existe la producción de acero, molibdeno, tungsteno, cadmio, bismuto y otros (antimonio, telurio y selenio) muestran la amplia variedad de minerales del inventario nacional.En cualquier caso, los principales minerales explotados son el cobre, el zinc, el plomo, la plata y el hierro. Los principales yacimientos de cobre actualmente en explotación se encuentran en el sur: Toquepala, Cuajone y Cerro Verde, existiendo además otros yacimientos importantes aún no explotados como La Granja (ya privatizado), Coroccohayco y Berenguela. El zinc se encuentra en casi toda la región andina, especialmente en las zonas centro y sudeste; las reservas probadas son de 5 millones de toneladas y las probables de 11 millones de toneladas. Los yacimientos de este metal son frecuentemente polimetálicos; como ejemplo, en el yacimiento de Antamina, situado en la cordillera Blanca, existen reservas probadas de 166 millones de toneladas al 1,3% de cobre, 1,1% de zinc, 0,04% de molibdeno y 16 g/t de plata.
PRODUCCIÓN MINERA | |||
Productos | 1996 | 1997 | 1998 |
Cobre | 18,5 | 3,5 | -39,0 |
Hierro | -26,2 | 1,7 | 8,7 |
Plata | 2,5 | 5,1 | -2,5 |
Plomo | 4,8 | 3,7 | -0,2 |
Zinc | 9,89 | 13,8 | 0,4 |
Oro | 12,4 | 18,4 | 22,1 |
Petróleo | -1,2 | -1,7 | -2,2 |
Gas natural | -7,0 | -2,7 | 69,2 |
Producto interno bruto minero | 2,9 | 5,8 | 4,8 |
Fuente: Instituto Nacional de Estadística e Informática. | |||
PETRÓLEO Y GAS NATURAL
Perú posee una larga tradición como productor de petróleo. Hasta la primera mitad del siglo, las operaciones en la costa norte estuvieron entre las primeras y más importantes actividades petroleras de Iberoamérica; en años posteriores se inició un permanente cuestionamiento de esta actividad que desembocó en posiciones políticas equivocadas y en la falta de políticas promocionales adecuadas, con lo que se produjo un deterioro de la situación y una caída de la industria petrolera nacional.
En el caso del gas natural, el país cuenta con uno de los mayores niveles de reservas probadas del mundo. En el yacimiento de Camisea, situado en la sierra del sur del país, se calcula que las reservas probadas son equivalentes a 2.200 millones de barriles de petróleo. La producción en 1998 fue de 14.432 millones de pies cúbicos, mientras que la de 1997 totalizó 8.531 millones de pies cúbicos.
PRODUCCIÓN DE HIDROCARBUROS | ||||
Producto | 1995 | 1996 | 1997 | 1998 |
Petróleo (1) | 44.442 | 43.909 | 43.157 | 42.191 |
Gas natural (2) | ... | ... | 8.530 | 14.431 |
(1) En miles de barriles. | ||||
Perú es el segundo productor de cobre iberoamericano, sólo después de Chile, que es el gran productor mundial de este mineral. En 1998 la producción de cobre ascendió a 483.000 toneladas, cifra que supone un decrecimiento del 3,9% con respecto al año anterior.
La empresa Southern Perú Copper Corporation (Spcc), cuyo principal accionista es la estadounidense Asarco, es el mayor productor del país, con una producción que alcanza unas 250.000 toneladas anuales en sus minas de Toquepala y Cuajone. Además, Asarco controla Minera Norperú, productora de zinc, plomo y plata.
Las reservas totales de cobre se estiman en más de 27 millones de toneladas de contenido fino de reservas probadas y más de 74 millones de toneladas en reservas probables. Los principales yacimientos en explotación de este mineral se encuentran en el sur del país (Toquepala, Cuajone y Cerro Verde), aunque existen otros yacimientos importantes como La Granja, Coroccohuayco y Berenguela.
PRODUCCIÓN DE COBRE | ||||
Producto | 1995 | 1996 | 1997 | 1998 |
Cobre | 409,7 | 485,6 | 503,0 | 483,3 |
Fuente: Instituto Nacional de Estadística e Informática. | ||||
EL ZINC
El zinc se encuentra en casi toda la región andina, especialmente en las zonas centro y sudeste. Las reservas probadas son de 5 millones de toneladas y las probables de 8 millones de toneladas en grandes yacimientos polimetálicos. Además, se estima que en el importante yacimiento de Antamina existen otros 920 millones de toneladas de recursos aún no valorados. Perú es el primer productor de este mineral de Iberoamérica y el tercer exportador mundial de concentrados de zinc, aunque sólo una cuarta parte de la producción total se refina para laminar en el país.
Perú es el primer productor de este mineral de Iberoamérica y el tercer exportador mundial de concentrados de zinc, aunque sólo una cuarta parte de la producción total se refina para laminar en el país. La producción de concentrados de zinc está dominada por la empresa Centromin (que fue transferida al sector privado en 1994) con un 35% del total, debido en gran parte a la explotación de la mina de Cerro de Pasco; el resto de la producción se distribuye entre varias empresas privadas.
PRODUCCIÓN DE ZINC | ||||
Producto | 1995 | 1996 | 1997 | 1998 |
Zinc | 692,3 | 760,4 | 865,3 | 869,0 |
Fuente: Instituto Nacional de Estadística e Informática. | ||||
EL PLOMO Y LA PLATA
Al igual que en el caso del zinc, el plomo se encuentra en yacimientos polimetálicos que se extienden a lo largo de toda la región andina, generalmente asociado a la plata. Esta última tiene unas reservas probadas de 772 millones de onzas y las probables ascienden a 1.672 millones de onzas. Los yacimientos se encuentran principalmente en el departamento de Arequipa, siendo los de Caylloma, Arcata y Orcopampa los más importantes.
El mayor productor es Centromin, con 76.000 toneladas de plomo y 370.000 onzas de plata. Durante el año 1998 la producción de plomo se contrajo ligeramente en un 0,2%, como consecuencia de la disminución registrada en la gran minería (-16,7%), aunque en contraste con los aumentos alcanzados por los estratos de la mediana (7,4%) y pequeña minería (44,9%). Centromin, única empresa dentro de la gran minería, redujo su producción en sus centros de Cerro y Yauricocha. Dentro de la mediana minería destacaron por sus mayores volúmenes de producción las empresas Atacocha, Santa Luisa, Morococha, Buenaventura, Santa Rita y Volcán.
PRODUCCIÓN DE PLOMO Y PLATA | |||||
Producto | Unidad de medida | 1995 | 1996 | 1997 | 1998 |
Plomo | Miles de toneladas | 237,6 | 248,9 | 258,2 | 257,7 |
Plata | Miles KF | 1.928,9 | 1.976,5 | 2.076,5 | 2.024,3 |
Fuente: Instituto Nacional de Estadística e Informática. | |||||
En varias zonas de la región andina existen yacimientos de oro, estando concentrados los principales distritos auríferos en el área de Palaz, al noroeste del país, y entre Nasca y Caravell en el sur. La producción de oro ha crecido en los últimos veinte años, principalmente a través de operaciones a pequeña escala. Sin embargo, algunas fuentes son mayores y se estima que podrían permitir a Perú colocarse entre los principales productores auríferos de América; además de la mina de Ayacocha, existen otras como Orcopampa, que produce 1.100 kilogramos de oro al año.
PRODUCCIÓN DE ORO | ||||
Producto | 1995 | 1996 | 1997 | 1998 |
Oro | 57,7 | 64,9 | 76,8 | 93,8 |
Fuente: Instituto Nacional de Estadística e Informática. | ||||
MINERAL DE HIERRO, FOSFATOS Y CARBÓN
Las reservas probadas de mineral de hierro ascienden a 835 millones de toneladas finas, siendo estimadas las probables en 2.800 millones de toneladas, volumen que permitiría una continuidad en la explotación durante unos 300 años. El único productor de hierro es la empresa Hierro Perú, ya privatizada; la mina explotada tiene reservas probadas de 500 millones de toneladas, con un 54% de hierro.
PRODUCCIÓN DE MINERAL DE HIERRO | ||||
Producto | 1995 | 1996 | 1997 | 1998 |
Mineral de hierro | 3.948,2 | 2.915,7 | 2.965,9 | 3.223,5 |
Fuente: Instituto Nacional de Estadística e Informática. | ||||
MINERIA EN PIURA
Minería:
TERMINAL DEL OLEODUCTO NORPERUANO
El Oleoducto Nor-Peruano, tiene su estación terminal en la bahía de Bayóvar. La Estación Terminal consta de un edificio administrativo y de control de operaciones, así como de un muelle de carga. El petróleo se recepciona en 14 depósitos de almacenamiento con una capacidad de dos millones de barriles de crudo.
El Muelle de carga constituido en un puerto natural, cuya profundidad es de 22 metros, tiene forma de "T" y mide 113 metros de largo desde la orilla y 599 metros entre sus extremos. Allí varan los barcos petroleros con capacidad hasta 250,000 toneladas, para omitirse a razón de 112,000 barriles de petróleo crudo por hora.
El depósito de fosfatos de Sechura, llamado también de Bayóvar se encuentra localizado a 30 Km. al Sur - Oeste de Sechura, es un yacimiento de gran volumen y esta considerado entre los mayores del mundo. Sus reservas se estiman en 549`970,100 T.M.
La zona de fosfatos abarca unos 2,000 Km.2 en el Desierto de Sechura, con sedimentación fosfórica. Comúnmente llamada "fosforito" y que químicamente es un fosfato tricálcico el mineral conocido como fluor - opatito, que se presenta en forma de módulos o gránulos redondeados llamados también fluorolitos.
El depósito de salmueras existente en la región se encuentra concentrado en tres cuencas principales ellas son: Zapayal, Namuc y Ramón siendo ésta última la más importante y localizada a 50 Km, al Nor - Este de Bayóvar.
Las salmueras que cubren las zonas de Ramón, Zapayal y Namuc, se encuentran ubicadas en un área de aproximadamente 611.5 Km.2 Se estiman unas reservas de 1,431 millones de T.M., repartidos en las diversas cuencas del lugar.
Los depósitos de azufre se encuentran localizados al Sur del Cerro Yllescas y a 4 Km. de la línea de playa de la zona de Reventazón en el Desierto de Sechura.
Este depósito a comienzos del siglo es explotado por la Compañía azufrera de Sechura, para lo cual se contaba con una planta horno y un ferrocarril (Reventazón a Bayóvar) para la exportación de este mineral. Las reservas probables se estiman en un millón de T.M. con leyes de 30 a 40%.
El verdadero potencial que enciman estos depósitos no se conoce, aún cuando se estima una cantidad bastante apreciable de muy buena calidad.
- En Sechura, específicamente en Bayóvar, se encuentran yacimientos de salmueras (soluciones acuosas de sales), yeso (sulfato cálcico), diatomitas ( una roca sedimentaria silícea de origen orgánico), andalucitas (mineral no metálico cuya composición química corresponde a la de su silicato de aluminio) ,polimetálicos y gas.
Elementos en común:
Cu: Ayabaca, canchaque, Morropón, Tambrogande.
Pb: Ayabaca
S: sechura, paita
Baritina: Ayabaca, huancabamba.
Salmueras: noreste de bayóvar.
Bentonita
Yeso
Es un metal de transición, cuya densidad o peso específico es de 8920 kg/m3 .
Tiene un punto de fusión de 1083ºC (1356 aprox. K).
El peso atómico del cobre es de 63,54.
Es de color rojizo.
Buen conductor del calor.
Después de la plata es el de mayor conductividad eléctrica.
Material abundante en la Naturaleza.
Material fácil y barato de reciclar de forma indefinida.
Forma aleaciónes para mejorar las prestaciones mecánicas.
Resistente a la corrosión y oxidación.
Prop. Químicas
Tiene poca actividad química y únicamente se oxida en el aire húmedo muy lentamente, recubriéndose de una capa de carbonato básico que lo protege de la corrosión posterior.
Su oxidación se favorece en medio ácido por lo que no es recomendable su uso en utensilios de cocina, ya que las sales que forma son eméticas (provocan vómitos).
Calentado al rojo se oxida y puede arder en el cloro y en el azufre.
Prop. Físicas
Es un sólido con un nítido brillo plateado cuando está recién cortado, pero que, en contacto con el aire, se vuelve inmediatamente gris azulado por formación de una capa superficial de carbonato básico.
Es muy blando (se raya con la uña), es maleable y dúctil, presenta una baja tenacidad y es un pobre conductor de la electricidad.
Prop. Químicas
No reacciona con el agua pura ni con el oxígeno, pero se corroe en el aire húmedo.
Es soluble en el ácido nítrico pero se altera poco con el sulfúrico o el clorhídrico a temperatura ambiente.
El hidróxido de plomo, que se forma por reacción lenta con el agua en presencia de aire, es soluble y tóxico. Aunque las aguas ordinarias suelen contener sales que forman un revestimiento sobre las tuberías, inhibiendo la formación del hidróxido de plomo soluble, las conducciones de agua potable no deben contener plomo.
Azufre:
Prop. Físicas
El azufre existe en dos variedades alotrópicas sólidas, pero en estado líquido se presenta en tres variedades más.
Si calentamos el azufre por encima de su punto de fusión va perdiendo fluidez y su color se transforma en pardo oscuro. Su viscosidad es tal que impide su vertido al volcar el recipiente.
Si aumentamos aún más la temperatura comienza un descenso de la viscosidad hasta que a 444,6ºC hierve. Este comportamiento anómalo del azufre (los líquidos disminuyen su viscosidad cuando se calientan) a la formación de estructuras moleculares en forma de anillo e incluso a la formación de polímeros de más de 100 átomos.
Prop. Químicas
El azufre tiene las valencias dos, cuatro y seis, como evidencian los compuestos sulfuro ferroso, FeS, el dióxido de azufre, SO2 y el sulfato de bario, BaSO4, respectivamente.
Cuando se quema en el aire, el azufre se combina con el oxígeno para formar dióxido de azufre, SO2, un gas incoloro pesado con un característico olor sofocante. El dióxido de azufre se libera en la atmósfera por la combustión de combustibles procedentes del petróleo, gas, aceites y carbón y constituye uno de los contaminantes más perniciosos.
► Se localiza en Ayabaca y Huncabamba.
► Esta formado por el azufre y el bario, llamándose también Sulfato de Bario: BaSO4.
Propiedades Físicas
1.- Es de color plateado y posee un olor inodoro.
2.- Es sólido, frágil y blando.
3.- Su Punto de Ebullición es1640 °C y su Punto de Fusión es 725 °C
Propiedades Químicas
1.- Reacciona con el agua y se oxida rápidamente en aire húmedo.
2.- El elemento es tan reactivo que no existe en estado libre en la naturaleza, siempre se encuentra formando compuestos con halógenos.
3.- Se presenta en forma de nitratos o sulfatos no solubles en agua.
Cinc
Propiedades Físicas
1.- Es poco abundante en la corteza terrestre pero se obtiene con facilidad.
2.- Es de color blanco azulado que arde en aire con llama verde azulada.
3.- Es insoluble en agua tanto en frío como en caliente y soluble en el alcohol, los ácidos y los álcalis.
4.- Es sumamente quebradizo
5.- Es un buen conductor del calor y la electricidad.
Propiedades Químicas
1.- Tiene un acentuado carácter reductor y reacciona con las bases concentradas con la mayor parte de los ácidos
2.- no se altera en el aire seco; en el aire húmedo se oxido
3.- Es un metal.
4.- Su estado de oxidación que presenta es +2.
► Esta conformado por el azufre y el calcio.
Propiedades Físicas
1.- Es un metal blanco, blando, que se puede cortar con un cuchillo.
2.- Se combina fácilmente con el oxígeno por lo que su brillo desaparece al estar en contacto con el aire.
3.- El calcio no causa quemaduras sobre la piel.
1.- Es menos reactivo químicamente que los metales alcalinos y que los otros metales alcalinotérreos.
2.- El calcio tiene un estado de oxidación, el cual es +2
- Es una arcilla utilizada en cerámica de grano muy fino (coloidal) del tipo de la montmorilinita que contiene bases y hierro.
► La bentonita sódica en suspensión aumenta la viscosidad de los líquidos y es muy importante para la preparación de lodos de perforación.
► Al disecarse la bentonita, cementa los granos sueltos, característica muy útil en la preparación de moldes de fundición metalúrgica.
Propiedades Físicas
1.- Es un metal maleable, tenaz.
2.- Es de color gris plateado y presenta propiedades magnéticas; es ferromagnético.
3.- Es buen conductor de la electricidad.
Propiedades Químicas
1.- Químicamente, el hierro es un metal activo.
2.- El Hierro posee dos estados de oxidación, los cuales son: +2 y +3.
3.- El hiero expuesto al aire húmedo, se corroe lentamente.
La cuantificación de las reservas
► Esto significa en que se debe hacer algo para que puedan aumentar las reservas en Piura y en el Perú.
► Debemos realizar proyectos para la cuantificaron de las reservas, es decir para que puedan aumentar y así en el futuro no se agoten.
► Si nosotros hacemos la cuantificación de las reservas pueda que en el futuro no se acaben tan rápido.
El estudio de la reserva del Agua y su uso
► El agua es un compuesto químico.
► El agua cubre el 72% de la superficie del planeta Tierra y representa entre el 50% y el 90% de la masa de los seres vivos.
► Es una sustancia relativamente abundante aunque solo supone el 0,022% de la masa de
la Tierra.
► Se puede encontrar esta sustancia en prácticamente cualquier lugar de la biosfera y en los tres estados de agregación de la materia: sólido, líquido y gaseoso.
► Se halla en forma líquida en los mares, ríos, lagos y océanos.
► En forma sólida, nieve o hielo, en los casquetes polares, en las cumbres de las montañas y en los lugares de la Tierra donde la temperatura es inferior a cero grados Celsius.
► En forma gaseosa se halla formando parte de la atmósfera terrestre como vapor de agua.
► Es fundamental para todas las formas de vida conocidas.
► Los humanos consumen agua potable. Los recursos naturales se han vuelto escasos con la creciente población mundial y su disposición en varias regiones habitadas es la preocupación de muchas organizaciones gubernamentales.
Su uso
► Se usa en:
► Consumo domestico
- Comprende el consumo de agua en nuestra alimentación, en la limpieza de nuestras viviendas, en el lavado de ropa, la higiene y el aseo personal...
► Consumo Público
- En la limpieza de las calles de ciudades y pueblos, en las fuentes públicas, ornamentación, riego de parques y jardines, otros usos de interés comunitario, etc..
► Uso en la agricultura y en la ganadería
- En agricultura, para el riego de los campos. En ganadería, como parte de la alimentación de los animales y en la limpieza de los establos y otras instalaciones dedicadas a la cría de ganado.
► El agua en la industria
- En las fábricas, en el proceso de fabricación de productos, en los talleres, en la construcción…
► El agua, fuente de energía
- Aprovechamos el agua para producir energía eléctrica (en centrales hidroeléctricas situadas en los embalses de agua).
- En algunos lugares se aprovecha la fuerza de la corriente de agua de los ríos para mover máquinas (molinos de agua, aserraderos…)
► El agua como vía de comunicación
- Desde muy antiguo, el hombre aprendió a construir embarcaciones que le permitieron navegar por las aguas de mares, ríos y lagos. En nuestro tiempo, utilizamos enormes barcos para transportar las cargas más pesadas que no pueden ser transportadas por otros medios.
► Deporte, ocio y agua
- En los ríos, en el mar, en las piscinas y lagos.
- Además pasamos parte de nuestro tiempo libre disfrutando del agua en las piscinas, en la playa, en los parques acuáticos o, simplemente, contemplando y sintiendo la belleza del agua en los ríos, las cascadas, los arroyos, las olas del mar, las montañas nevadas.
Derechos de la población en la zona donde se exportan los recursos mineros
► Paralelamente a los cambios en la legislación minera, se produjeron cambios en la
normativa general, con el fin de modernizar las actividades productivas, así como facilitar y atraer la inversión privada dentro del país.
► La minería en Perú es centro de atención pública desde diferentes perspectivas.
► Una de ellas es muy optimista, considera que con la puesta en operación de grandes
yacimientos como Yanacocha, Pierina y Antamina, el sector comienza una etapa de
crecimiento económico sostenido que entusiasma a funcionarios del gobierno y al sector
empresarial.
► Sin embargo, la opinión pública tiene una imagen algo menos optimista
al respecto, ya sea por la débil articulación de estos proyectos con el desarrollo local de
las comunidades adyacentes a las operaciones o, también, por la perspectiva de las
operaciones desde el punto de vista ambiental.
► Uno de los aspectos más criticados del nuevo sistema de gestión pública ambiental
del sector es la participación de la sociedad civil en el proceso de aprobación de los
planes de manejo ambiental.
► El cobre tiene una gran variedad de aplicaciones a causa de sus ventajosas propiedades, como son su elevada conductividad del calor y electricidad, la resistencia a la corrosión, así como su maleabilidad y ductilidad, además de su belleza.
► Debido a su extraordinaria conductividad, sólo superada por la plata, el uso más extendido del cobre se da en la industria eléctrica.
► Su ductilidad permite transformarlo en cables de cualquier diámetro, a partir de cualquier diámetro, a partir de0,025 mm.
► La resistencia a la tracción del alambre de cobre estirado es de unos 4.200 kg/cm2.
► Puede usarse tanto en cables y líneas de alta tensión exteriores como en el cableado eléctrico en interiores, cables de lámparas y maquinaria eléctrica en general: generadores, motores, reguladores, equipos de señalización, aparatos electromagnéticos y sistemas de comunicaciones.
► La mayor parte del hierro se utiliza en formas sometidas a un tratamiento especial, como el hierro forjado, el hierro colado y el acero.
► Comercialmente, el hierro puro se utiliza para obtener láminas metálicas galvanizadas y electroimanes.
► Los compuestos de hierro se usan en medicina para el tratamiento de la anemia, es decir, cuando desciende la cantidad de hemoglobina o el número de glóbulos rojos en la sangre.
► Debido a su elevada proporción resistencia-peso es muy útil para construir aviones, vagones ferroviarios y automóviles, y para otras aplicaciones en las que es importante la movilidad y la conservación de energía.
► Por su elevada conductividad térmica, el aluminio se emplea en utensilios de cocina y en pistones de motores de combustión interna.
► Un alambre de aluminio de conductividad comparable a un alambre de cobre es más grueso, pero sigue siendo más ligero que el de cobre.
► El uso principal de la fluorita ha sido la producción de ácido fluorhídrico, material esencial en la fabricación de criolita sintética y de fluoruro de aluminio para la industria del aluminio, y en muchas otras aplicaciones de la industria química.
► La fluorita es un flujo común en la fundición de acero.
► Se usa en grandes cantidades en la producción de esmalte y de vidrio translúcido; los cristales perfectos se utilizan en la fabricación de lentes apocromáticas.
► El fosfato terciario de sodio se usa como detergente y ablandador del agua; para aportar fosfatos al ganado, se usa el hidrogenofosfato de calcio hidratado, como suplemento alimenticio.
► El fosfato primario de calcio, se emplea como ingrediente en fertilizantes para plantas.
► La industria de almidones y azúcares ha sido testigo de la sustitución de los métodos de separación tradicionales como los filtros prensa y los filtros rotatorios al vacío por la filtración por membranas, en varias de las etapas del proceso.
► Las industrias de la caña de azúcar y la remolacha (betabel) tradicionalmente han utilizado métodos como el alcalizado y floculación para clarificar los jugos no procesados y eliminar las impurezas como ceras, dextrosas y gomas, antes de enviar el jugo a su refinación para su posterior evaporación y cristalización.
Corrientes de desecho de productos lácteos y alimentos vegetales
Agua de canal de arrastre de papa (patata)
Pulido de condensados del evaporador
Recuperación y re-uso de soluciones de limpieza usadas
Producción/recuperación de pigmentos
Gelatina industrial
Recuperación de metales
Intermedios Farmacéuticos
Sales Industriales
Clarificación de cáusticos
Fécula de trigo
Tomate (jitomate)
Plantas de productos lácteos
Plantas de clarificación
Proceso de cal
Fécula de maíz
Recuperación de fécula de patata (papa)
Recuperación de agua adherida
Límites
Este – Nor Este : Vertientes altas del río Huancabamba
Sur – Sur Oeste : Vertientes altas de los ríos Ñaupe, Santa Rosa, Quebrada Piedra Blanca
Oeste – Nor Oeste : Vertientes altas del río Chira
Sur Oeste : Océano Pacífico
Sur Este : Lagunas Ramón, y Ñapique y el Desierto de Sechura
Distritos comprendidos en la Cuenca del Río Piura
La Región Piura tiene 35,892.49 Km2 de superficie, de la cual 12,216 Km2 pertenecen a la cuenca del río Piura, que comprende a cinco provincias.
Provincia de Piura : Piura, Castilla, Catacaos, La Arena, La Unión, Cura Mori, El Tallan y Tambogrande
Provincia de Morropón : Chulucanas, Buenos Aires, Chalaco, La Matanza, Santo Domingo, Santa Catalina de Mossa, Morropón, San Juan de Bigote, Salitral y Yamango
Provincia de Sechura : Sechura, Bernal, Rinconada Llicuar, Bellavista de la Unión, Cristo Nos Valga y Vice
Provincia de Ayabaca : Frías
Provincia de Huancabamba : Canchaque, Huarmaca, San Miguel del Faique y Lalaquíz
Cuarto bimestre
Reacciones químicas
Es un fenómeno donde se forman sustancias nuevas en relación a las primitivas.
Ejm:
Soda cáustica + ácido clorhídrico
Produce dos compuestos totalmente distintos:
à Cloruro de sodio + agua
E.Q:
Na OH + HCl à Na Cl + H2O
Condiciones o requisitos para que una reacción química sea válida
- Debe cumplir con hechos experimentales.
- Las formulas de los compuestos tienen que estar correctamente escritos.
- Tiene que cumplir con la ley de conservación de la materia y la energía.
Clases de reacciones químicas
A. Sustancias reactantes
1. Reacciones de síntesis, adición, combinación.
S + O2 à SO2
Sulfuro de plata más oxigeno molecular produce sulfato molecular.
Ag2 S + 2 O2 à Ag2 S O4
Una molécula de ácido clorhídrico más amoniaco produce cloruro de amonio.
H Cl + NH3 à N H4 Cl
2. Reacciones de descomposición o disociación térmica
Oxido mercúrico por acción del calor se descompone en mercurio atómico más oxígeno molecular.
2Hg O -D-> 2Hg + O2
Carbonato de calcio por acción del calor produce cal viva mas dióxido de carbono.
Ca C O3 -D-> Ca O + CO2
3. Reacciones de sustitución o desplazamiento
Fierro más ácido sulfúrico produce sulfato ferroso más hidrógeno molecular.
Fe + H2SO4 à Fe S O4 + H2
Sodio más agua produce hidrógeno de sodio más hidrógeno molecular.
2Na + 2H2O à 2Na OH + H2
4. Reacciones de doble desplazamiento
Acido sulfúrico más hidróxido de bario produce sulfato de bario más agua.
H2SO4 + Ba (OH)2 à Ba(SO4) + 2H2O
Acido clorhídrico mas sulfuro ferroso produce cloruro ferroso mas acido sulfhídrico.
2H Cl + Fe (S) à Fe Cl2 + H2S
B. Por la energía calorífica
1. Reacciones exotérmicas: son aquellas que desprenden energía calorífica.
Mg + 2H Cl à Mg Cl2 + H2 + D
C3 H8 + O2 à CO2 + H2O + D
2. Reacciones endotérmicas: Son aquellas que necesitan de la energía calorífica.
Anh. Carbónico más agua mas energía calorífica produce glucosa mas oxigeno molecular.
C. Reacciones de combustión: es un tipo de reacción de oxidación que va acompañada de gran desprendimiento de calor, muchas veces con luz.
-Con luz: combustión de gas propano
-Sin luz: combustión de azucares o polihidratados de carbono y grasas dentro de nuestro organismo.
*La combustión de hidrocarburos, alcoholes, cetonas, ácidos orgánicos y azúcares. En una combustión completa los productos siempre son: Anh. Carbónicos más agua
Ejm:
Etanol mas oxigeno molecular produce anhídrido carbónico más agua.
CH3-CH2 OH + 3O2 à 2CO2 + 3H2O
* Combustión incompleta: generalmente se produce por deficiencias de oxígenos y los productos son: monóxido de carbono y agua
Si la deficiencia de oxigeno es mayor se produce carbono en forma de hollín y agua en forma de vapor.
D. Reacción REDOX: son aquellas reacciones don de se producen ganancias y perdida de electrones o una variación de oxidación de los átomos.
Oxidación
Es un fenómeno donde se produce perdida de electrones es decir un aumento en el E. Oxidación.
Reducción
Es un fenómeno donde se produce ganancia de electrones o una disminución en el E. Oxidación.
Sustancia oxidada
Es aquella sustancia que contiene el átomo cuyo número de oxidación aumenta o pierde electrón.
Sustancia reducida
Es aquella sustancia que contiene el átomo cuyo numero de oxidación disminuye o gana electrones.
La sustancia que provoca la oxidación se le denomina agente oxidante y la sustancia que provoca la reducción se le denomina agente reductor.
-Sustancia que se ha oxidado HCl (acido clorhídrico), y el agente o quien la oxido fue el dióxido de manganeso.
-Sustancia que se ha reducido es el MnO2 (Dióxido de manganeso), y el agente o quien la ha reducido es el acido clorhídrico (HCl).
Reducción Oxidación
ANOMALIAS DEL CROMO Y MANGANESO
- Cr --> +2 +3 +6
- Mn --> +2 +3 +4 +6 +7
- Cr O3 --> anh. Crómico - ox. de cromo(VI)-trióxido de cromo
- Cr (OH)2 --> Hidrox. Cromoso
- Mn O2 --> ox. de manganeso(IV) – diox. de manganeso
- Mn (OH)2 --> Hidrox. De manganeso (II)
- Mn (OH)3 --> hidrox. De manganese (III)
1. Por tanteo
2. REDOX
Pasos para realizar el balanceo por REDOX:
2. Identificar el número de electrones ganados o perdidos.
3. Igualar el número de electrones con coeficientes.
4. Realizar la semi-ecuación.
5. colocar los coeficientes en la ecuación.
6. Si no esta totalmente balanceado usar el balanceo por tanteo.
Balance de ecuaciones químicas
Métodos
1) Por tanteos
2) Redox
1.- â nítrico + â Sulfhídrico à Monóxido de Nitrógeno + Azufre + Agua
Reducción Oxidación
2.- Cloruro de litio + Permanganato de potasio + â Sulfúrico à Cloro molecular + Sulfato de manganeso (II) + Sulfato potasio + Sulfato de litio + Agua
Li Cl + KMn O4 + H2SO4 à SCl2 + Mn SO4 + K2SO4 + Li2SO4 + H2O
Importancia de la química orgánica
Los seres vivos estamos formados por moléculas orgánicas, proteínas, ácidos nucleicos, azúcares y grasas. Todos ellos son compuestos cuya base principal es el carbono. Los productos orgánicos están presentes en todos los aspectos de nuestra vida: la ropa que vestimos, los jabones, champús, desodorantes, medicinas, perfumes, utensilios de cocina, la comida, etc.
Las Funciones Químicas Orgánicas
Una función química es un conjunto de compuestos que tienen propiedades muy parecidas en virtud a que sus moléculas contienen uno o más átomos iguales.
Representación convencional de los elementos que forman un compuesto o molécula. En la fórmula química se indican los elementos presentes en cada molécula y como subíndice junto a cada uno el número de átomos de ese elemento presentes.
1.) HIDROCABUROS
2.) FUNCIONES OXIGENADAS:
Alcoholes
Fenoles
Aldehídos
Cetonas
Éteres
Ácidos
Orgánicos
Ésteres
Sales Orgánicas
3.) FUNCIONES NITROGENADAS:
Aminas
Amidas
Cianuros
Nitrilos
Aminoácidos
HIDROCARBUROS
Los hidrocarburos y sus compuestos derivados se pueden clasificar en general en tres grandes categorías:
1. Hidrocarburos Aciclicos, formados por cadenas de átomos de carbono en las que no hay límite, es decir es una cadena abierta. (Hay carbonos primarios)
2. Hidrocarburos cíclicos, compuestos por átomos de carbono encadenados formando una figura, es decir forman una cadena cerrada. (No hay carbonos primarios)
Alcanos:
H H H
H -C - C - C - H --) H3C – CH2 - CH3 --) C3 H8
H H H
H H H
C = C - C - H --) H2C = CH - CH3 --) C3 H6
H H
Alquinos:
H
H -C - C ≡ C-H --) H3C - C ≡ CH --) C3 H4
H
Formula funcional: Es la formula que destaca el grupo funcional que se encuentra en el compuesto.
CHO - CH2 – CH3 ---) C2 H5 CHO - -> PROPANAL
CH2 = CH –CHO - -) C2 H3 CHO - -> PROPENAL
BUTANAL - -) C3 H7 CHO
EXANAL - -) C5 H11 CHO
TRIDECANODIAL - -) C11 H22 (CHO)2
EXENAL - -) C5 H9 CHO
TRIDECA - DIENO - INO - DIAL - -) C11 H14 (CHO)2
Ejercicios:
DODECATRIENOINOAL: C11 H13 CHO
OCTINODIAL: C6 H8 (CHO)2
HEPTENODIINOAL: C6 H3 CHO
DECATRIENODIINOAL: C9 H5 CHO
HEPTENO 3 DIINO 1- 5 AL 7
HC ≡ C – CH = CH - C ≡ C – CHO

No hay comentarios:
Publicar un comentario